纤毛是基于微管的细胞器,从细胞表面突出。纤毛异常可导致多种纤毛病,包括多囊肾病(PKD)、Bardet-Biedl综合征(BBS)和I型口-面-指综合征(OFD1),这些疾病显示与纤毛形成相关的遗传缺陷。虽然越来越多的人类疾病归因于纤毛缺陷,但一些纤毛病基因的功能或调节机制尚不清楚。由于多纤毛细胞(mcc)深埋于体内,对纤毛发生的研究具有挑战性。在这里,我们证明了ik是体内纤毛发生所必需的。
在缺乏ik的情况下,斑马鱼胚胎表现出各种纤毛病表型,如身体弯曲、耳石异常和肾脏囊肿形成。RNA测序分析显示,ik正调控纤毛组装所需的d1表达。事实上,ik的缺失导致了带有纤毛缺陷的ofd1表达下调,而这些纤毛缺陷在ik突变体中通过恢复ofd1的表达得以修复。有趣的是,ik影响了肾脏近端小管的纤毛形成,但对远端小管没有影响。
本研究首次在体内证实了ik在纤毛发生中的作用。斑马鱼胚胎中ik的丧失表现出各种纤毛病表型,纤毛组织中纤毛形态异常。我们在ik - ofd1轴上的发现为ik在人类临床纤毛病研究中的生物学功能提供了新的见解。
初级纤毛是从真核细胞表面突出的微管细胞器。在大多数细胞类型中,初级纤毛高度依赖于细胞周期的阶段,因为它们在细胞周期进程中受到动态调节。它们在G0和G1期开始形成,通常在S/G2期解体,最后在进入有丝分裂前进行快速吸收[1]。初级纤毛作为细胞天线和中间外部刺激,在组织发育的内稳态中决定细胞的时空命运[2,3]。因此,原发纤毛在组织或器官中的功能障碍可导致多种遗传性多性状和综合征性疾病,通常称为纤毛病,如多囊肾病、Bardet-Biedl综合征、肾病和色素性视网膜炎[4,5,6,7,8]。纤毛病可由多种因素引起,包括基因突变、纤束内转运蛋白缺失、基底体对接不当、纤毛成分基因前mrna剪接异常等[9,10,11,12,13,14]。虽然越来越多的人类疾病归因于纤毛病,但其致病因素及其在纤毛缺陷中的机械和分子功能在很大程度上尚未在体内探索。因此,阐明与纤毛病相关的各种基因的分子相关性和功能是具有挑战性的。
核蛋白IK也被称为RED,因为存在序列重复精氨酸(R)、谷氨酸(E)和天冬氨酸(D)残基,它是有丝分裂过程中细胞进展所必需的,并通过参与mrna前剪接而具有基因组稳定性。在结构上,IK与SMU1结合,相互作用的两种蛋白作为二聚体复合物发挥协同功能,相互稳定。因此,缺乏一种蛋白会导致互易蛋白降解,导致细胞功能紊乱[15]。在有丝分裂中,IK在纺锤体极点招募核心有丝分裂检查点蛋白有丝分裂抑制缺陷1 (mitotic arrest deficient, MAD1),并在纺锤体组装检查点的有丝分裂进程中发挥作用[16,17]。此外,ik缺失的细胞显示PP1/PP2A活性受到抑制,这随后有助于有丝分裂丝氨酸/苏氨酸激酶成员Aurora激酶A的持续活性[18]。同时,IK也被认为是剪接体B复合物激活所必需的,因为它在短内含子的pre-mRNA剪接中起作用[19]。虽然ik在不同组织中的表达水平不同,但ik在特定组织中的确切作用尚不清楚。在小鼠中纯合子敲除ik会导致胚胎死亡,我们之前使用斑马鱼模型证明ik的缺失会损害骨骼肌的体内发育[20]。然而,IK在体内的生理作用还需要进一步的研究。
oral- face -digital 1 (ofd1)是在oral- face -digital syndrome (OMIM 311200)中报道的首个基因[21,22,23,24],编码位于初级纤毛中心体和基底体的ofd1蛋白[21]。在纤毛发生过程中,它调节母中心粒的中心粒长度和远端附属物的形成[25,26,27]。因此,ofd1的缺失导致中心粒远端区域的异常伸长,长中心粒形成结构不稳定的微管,并伴有异常的翻译后修饰[27]。在人类中,ofd1的突变会导致纤毛形态异常,并发生以面部、口腔和手指畸形为特征的OFD综合征[28,29,30]。OFD综合征患者表现出与纤毛病相同的一些特征,如囊性疾病和模式异常[28]。迄今为止,对缺乏OFD1的纤毛功能障碍的研究已经使用了各种体外和体内模型[25,27,31,32,33,34]。在斑马鱼中,ofd1的缺失导致体轴弯曲、水肿和库普弗氏囊血管内液体流动紊乱,并导致纤毛轴突缩短和断裂[31]。然而,控制纤毛组装之外的ofd1表达的分子机制尚不清楚。
在这里,我们发现IK与ofd1的表达呈正相关,这是纤毛组装所必需的。IK缺失可下调ofd1的表达,而ofd1表达的恢复可克服IK缺失引起的纤毛缺陷。我们的研究结果表明IK-OFD1轴对体内正常纤毛发育至关重要,并为临床人类纤毛病提供了新的生物学见解。
斑马鱼被认为是最适合研究ik功能的体内模型,因为纯合敲除ik在小鼠胚胎中是致命的,而在斑马鱼胚胎中则不是。为了探索IK在体内的功能,我们使用全载原位杂交(WISH)和定量RT-PCR检测了斑马鱼胚胎发生过程中IK的时空表达(图1A,附加文件1:图S1)。Ik在靠近胚层边缘的1个细胞中表达,但总体母系表达水平明显较低(约为14个体细胞)。然而,在母体向合子过渡(MZT)后(斑马鱼受精后约21小时),ik的表达变得强烈(受精后1天),特别是在中胚层谱系的器官中,包括头部、肾原和肌肉。在合子期,ik普遍分布于尾芽,并逐渐富集,特别是在纤毛组织如头和肾原管中(附加文件2:图S2)。这些时空表达分析表明,ik在合子期的表达比早期高得多,这意味着ik可能在斑马鱼纤毛组织中具有功能作用。接下来,为了表征IK在体内的作用,我们使用CRISPR/Cas9系统分析了先前产生的纯合IK敲除斑马鱼突变体的表型[20],并观察到IK突变体表现出纤毛病表型。在受精后2天(dpf), ik突变体显示出明显的体曲率为100% (n=112),耳石表型异常,如融合或多形态(83%;n=93 / 112)(图1B)。此外,80%的肾原形成囊肿(n=90 / 112)。除了这些表型外,心脏环的随机左右(LR)轴被认为是斑马鱼发育早期由库普弗氏囊中运动纤毛缺陷引起的主要纤毛病表型[35],因为纤毛器官库普弗氏囊在早期决定了大脑、肠道和心脏的LR对称性。为了确定ik突变体中LR不对称模式的改变,我们使用心肌肌球蛋白轻链2 (cmlc2)作为斑马鱼胚胎整个心脏的标记物,进行了WISH分析以检测心脏中LR不对称。野生型(WT)胚胎和ik突变体在LR组织上没有差异,具有正确的s形环(d环)(图1C)。这些结果表明,ik的缺失导致了主要的纤毛病表型,但与LR不对称无关。接下来,我们在单细胞期利用morpholino反义寡核苷酸(MOs)靶向外显子2,在斑马鱼胚胎中去除ik的表达,进行拯救实验(图1D, E)[20,36]。Ik突变体表现出多种多样的纤毛病表型,包括体轴曲率(74.6%;N=50 / 67),耳石缺陷(50%;22例中有11例),肾原囊肿占85.71%;n=30 out of 35)(图1F)。为了验证ik MO敲除的特异性,我们另外与MO共注射编码全长野生型ik的合成mRNA。共注射的ik mRNA挽救了ik变形体的所有缺陷纤毛表型,从而排除了脱靶效应的可能性。
图1
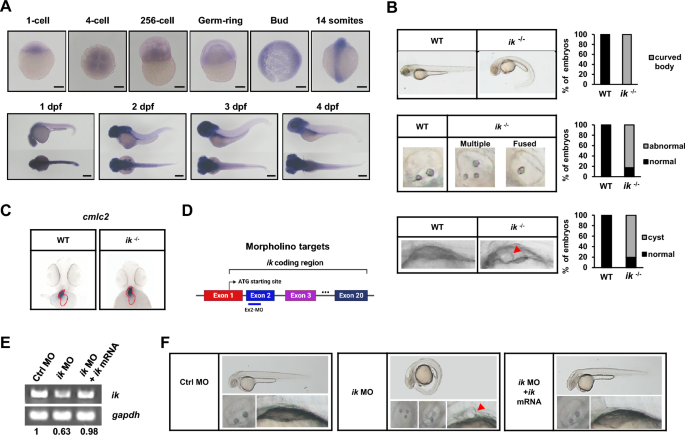
斑马鱼ik突变体表现出类似纤毛病的表型(A)斑马鱼ik mRNA在不同发育阶段(1细胞、4细胞、256细胞、胚环、芽、14体、1 dpf、2 dpf、3 dpf和4 dpf)的全安装原位杂交(WISH)分析。比尺,250 μm (B)在2 dpf下,WT胚胎和ik突变体的体曲率、耳石和肾原囊肿(ik?/?)的明场显微镜图像。ik突变体肾原囊肿以红色箭头标记。堆叠条形图显示了具有腹侧弯曲体、异常耳石表型和囊肿形成的胚胎的百分比(C) cmlc2在WT胚胎和ik突变体中2 dpf处全心位置的WISH分析(D)斑马鱼ik编码区示意图。本研究中使用的morpholino的靶区(外显子2)使用蓝线(E)对对照morphants (MO)、ik MO和ik MO/ik mRNA共注射胚胎中ik mRNA的表达进行RT-PCR分析。gapdh作为归一化对照,标记ik/gapdh mRNA表达的波段强度比(F)对照MO、ik MO和ik MO/ik mRNA共注射胚胎在2 dpf时的亮场显微镜图像。捕获全身、耳石、肾囊肿。肾原囊肿以红色箭头标记
为了确定ik缺失胚胎中纤毛病表型的机制,我们接下来重点研究了ik对纤毛发生的影响,并通过对纤毛特异性标志物ac-α-微管蛋白的免疫染色证实了ik突变体毛细胞中纤毛发生异常。在ik突变体的毛细胞中,纤毛的数量比WT胚胎减少了约50%,纤毛的长度缩短了约30%(图2A)。此外,我们用Tg(brn3c:GFP)斑马鱼纤毛束系在毛细胞上标记绿色荧光蛋白(GFP)。由于brn3c基因是POU (pitt - oct - unc)结构域转录因子brn3亚家族(brn3a、brn3b和brn3c)的成员,在听觉和前庭毛细胞中选择性表达,因此Tg(brn3c:GFP)系可以作为研究毛细胞纤毛的合适模型。我们观察到ik型Tg(brn3c:GFP)胚胎毛细胞纤毛长度和束数减少(图2B)。然而,将ik的全mrna共注射到ik morphant Tg(brn3c:GFP)胚胎中,与对照组相比,ik morphant Tg(brn3c:GFP)胚胎的异常纤毛表型几乎完全恢复。接下来,研究了钾消耗对原肾纤毛发生的影响。ik突变体在肾原中显示随机错误的纤毛,有趣的是,我们观察到ik突变体中肾原的纤毛受到干扰,特别是在前区,而不是在后区(图2C)。为了确定纤毛发生异常是否与纤毛超微结构的改变有关,我们利用透射电镜(TEM)分析了纤毛轴突的组织或组成。与WT胚胎相似,ik突变体在原肾中也有9 + 2排列的纤毛(图2D,附加文件3:图S3)。结果表明,由ik耗竭引起的纤毛形态异常不是由于轴突排列受损所致。与ik突变体相似,58%的ik突变体在肾原中显示随机错误的纤毛,并且通过联合注射ik mRNA来挽救这种异常(图2E)。与Ik突变体相似,Ik突变体仅在前区表现出异常的纤毛,而在后区则没有。这些结果表明IK特异地在肾前区起作用,而不是在肾后区起作用。
图2
ik缺失导致纤毛形态异常(A)在2 dpf时使用抗乙酰化-α-微管蛋白(绿色)对WT胚胎(n=3)和ik突变体(n=5)的内耳纤毛进行全载免疫染色(白框)。标尺,20 μm。WT胚和ik突变体在2 dpf时内耳纤毛长度和数量的定量图。*p < 0.05, ***p < 0.001 (B) 3 dpf时对照MO、ik MO和ik MO/ik mRNA共注射Tg(brn3c:GFP)胚胎共聚焦显微图像。比例尺,20μm。对照MO (n=12)、ik MO (n=17)和ik MO/ik mRNA共注射胚胎(n=10)内耳纤毛长度和数量的定量分析。**p < 0.01, ***p < 0.001 (C)使用抗乙酰化-α-微管蛋白(绿色)对WT和ik突变体2 dpf时肾原细胞中总纤毛的全载免疫荧光(左)。比例尺,100μm。2 dpf WT胚胎和ik突变体近端和远端小管中原肾纤毛的放大图(右),抗乙酰化-α-微管蛋白染色(绿色),细胞核DAPI染色(蓝色)。比例尺,20μm。堆叠柱状图显示了WT胚胎和ik突变体在2 dpf时肾前管中纤毛表型胚胎的百分比。(D)透射电镜结果显示ik突变体肾原管纤毛的超微结构。显示“9 + 2”配置的横截面(黑色圆圈)。刻度条,100 nm (E)对照MO、ik MO和ik MO/ik mRNA在3 dpf时共注射抗乙酰化-α-微管蛋白(绿色)的胚胎肾原细胞中总纤毛的全载免疫荧光(左)。比例尺,100μm。在2 dpf对照MO、ik MO和ik MO/ ik mRNA共注射的胚胎中,用抗乙酰化-α-微管蛋白(绿色)和DAPI染色的肾前和后肾原管纤毛的放大图(右)。比例尺,20μm。堆叠柱状图显示基于前肾前管纤毛形态的胚胎百分比(胚胎纤毛形态异常百分比:对照MO, 0%;比如密苏里州,58%;ik MO + ik mRNA, 0%)
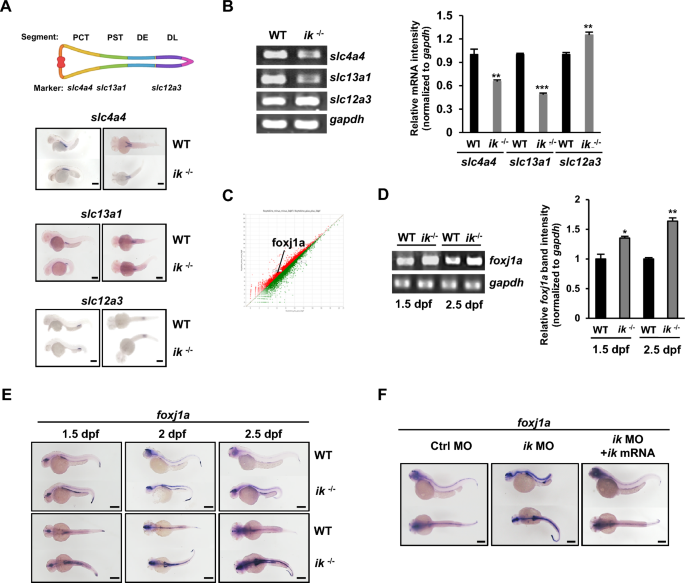
纤毛缺陷的组织一般表现为发育受损[37,38],原发纤毛异常会导致肾脏发育受损,如常染色体隐性多囊肾病(ARPKD)[39]。因为ik突变体在肾原中也表现出异常的纤毛发生,它们可能在肾脏发育中有缺陷。因此,我们通过测量近端小管片段标记基因的空间表达来检测近端小管发育是否异常。slc4a4在近曲小管(PCT)和slc13a1在近直小管(PST)的表达在ik突变体中减少(图3A)。有趣的是,在ik突变体中slc4a4的空间mRNA表达量比WT短,PST标记slc13a1的空间mRNA表达量也比WT短,PST结构较弱,而远端晚段标记slc12a3的表达量在ik突变体中略有增加。slc12a3的空间表达结构与WT相比没有变化。通过逆转录聚合酶链反应(RT-PCR)证实了片段标记基因的水平(图3B)。这一结果表明,ik突变体具有异常的肾脏发育,表现出特定于前部而非后部的纤毛形态受损。Foxj1a是肾脏运动纤毛形成的必需基因,在肾脏发育受损或囊肿形成时被迅速诱导[40]。因此,我们检测了foxj1a在肾脏发育异常和囊肿形成的ik突变体中是否表达增加。RNA测序(RNA-seq)分析显示,与WT胚胎相比,ik突变体中foxj1a的表达增加了1.8倍,变化幅度为log2倍(图3C), RT-PCR也证实了这种表达增强(图3D)。此外,通过WISH分析foxj1a在1.5-2.5 dpf下的时空表达(图3E)。在1.5 dpf时,与WT胚相比,ik突变体纤毛组织(包括前肾)中的foxj1a表达上调,并持续维持在2.5 dpf。接下来,我们将ik mRNA共注射到ik变异体中进行拯救实验,以检验ik过表达是否直接影响foxj1的表达。与ik嵌合体foxj1a表达显著增强不同,ik嵌合体共注射ik mRNA后foxj1a表达与WT胚相似(图3F)。
图3

WT胚胎和ik突变体2 dpf时肾原管标记slc4a4、slc13a1和slc12a3的WISH分析。条形图,250 μm (B) RT-PCR分析slc4a4、slc13a1和slc12a3在WT胚和ik突变体中2 dpf的表达。Gapdh作为归一化控制。使用Image J软件将slc4a4、slc13a1和slc12a3归一化为gapdh强度的相对波段强度图形化表示(一式三份)。**p < 0.01, ***p < 0.001 (C)基于RNA-seq数据的线性滤波模型显示WT和ik突变体在3 dpf时整体基因表达的相关性。foxj1a图点位显示。(D) 1.5和2.5 dpf时WT胚和ik突变体foxj1a表达的RT-PCR分析。Gapdh作为归一化控制。foxj1a相对于gapdh强度归一化后的相对波段强度用图形表示(3个重复)*p < 0.05, **p < 0.01 (E) WT和ik突变体foxj1a在1.5、2和2.5 dpf下的WISH分析。比尺,250 μm (F)在2.5 dpf时,对照MO、ik MO和ik MO/ik mRNA共注射胚胎中foxj1a的WISH分析。标尺,250 μm
由于发现ik对于纤毛组织发育中纤毛的正常发生至关重要,因此我们分析了RNA-seq数据,以确定WT和ik突变体之间差异表达的纤毛组装相关基因。根据链特异性指数分析ik突变体RNA-seq中log2转化转录组的表达,p < 0.05为有统计学意义。还鉴定了参与纤毛组装的差异表达基因(Gene ontology(GO):0060271)(图4A)。在筛选的纤毛组装基因中,包括ift57、ift172、dzip1l和ofd1,我们重点研究了ofd1基因作为ik的靶基因,其log2倍变化为0.59,因为之前已知的ofd1突变体的生理表型与ik突变体非常相似,表现为纤毛病,如体曲线、耳石异常和广泛的畸形[31]。事实上,在ik突变体中,ofd1的表达下调(图4B),并且在头部和肾原中空间上降低(图4C)。为了排除脱靶效应的可能性,我们还进行了救援实验。RT-PCR(图4D)和WISH实验(图4E)显示,共注射ik mRNA可导致ik变形体中d1表达下调。这意味着ofd1在体内是ik的下游靶点。接下来,我们进行了体外拯救实验,以证实IK作为OFD1的转录上游调节剂。IK在人RPE细胞中被敲低,野生型IK或突变型IK (T485A;将苏氨酸突变为不能磷酸化的丙氨酸)重新转染(附加文件4:图S4)。与体内结果相似,在ik敲低(KD)细胞中OFD1 mRNA水平下调,并被野生型ik拯救。相反,将突变体ik (T485A)转染IK-KD细胞后,OFD1 mRNA的表达仍维持在低水平,未得到挽救。这些结果提供了令人信服的证据,证明IK是OFD1的转录上游调节剂。此前,由于IK也被认为是pre-mRNA剪接因子[19],我们分析了斑马鱼IK突变体中d1表达下调是否由pre-mRNA剪接错误引起。因此,我们观察到,在与WT序列相同的ik突变体中,ofd1前mrna正常剪接(附加文件5)。此外,ik负调控极光激酶,极光激酶不仅参与细胞周期,还在纤毛相关信号传导中发挥作用[16,17,18]。因此,我们研究了极光激酶的表达,以检验在ik突变体中ofd1的下调可能是由极光激酶引起的。在RT-PCR分析中,极光激酶a和b的mRNA水平在WT和ik突变体中没有差异(附加文件6:图S5A)。此外,RPE细胞中极光激酶A或B的敲低也不影响OFD1在蛋白水平上的表达(附加文件6:图S5B)。这表明,在ik突变体中,odf1的下调是ik的直接作用,独立于极光激酶。
图4
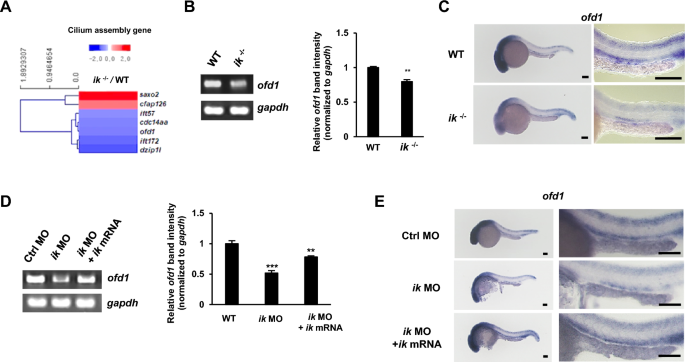
(a) 7个差异表达的纤毛组装基因的热图与WT胚相比,ik突变体的热图变化至少为1.5 > log2倍。相对于平均值的上调的deg用红色表示。下调的deg用蓝色表示(刻度条,mRNA比率的log 2) (B) WT胚胎和ik突变体中ofd1 mRNA表达的RT-PCR分析。Gapdh作为归一化控制。ofd1相对于gapdh强度归一化的相对波段强度使用Image J软件图形化地表示(一式三份)。在1 dpf时,WT胚和ik突变体中ofd1的WISH值p < 0.01 (C)。标尺,100 μm。WT和ik突变体在1dpf时的肾原放大图。比尺,150 μm (D)在1.5 dpf时对照MO、ik MO和ik MO/ik mRNA共注射胚胎中ofd1 mRNA表达的RT-PCR分析。Gapdh作为归一化控制。使用Image J软件,将ofd1相对于gapdh强度归一化的相对波段强度图形化地表示(在三个单独的实验中)。**p < 0.01, **p < 0.001 (E)对照MO、ik MO和ik MO/ik mRNA共注射胚胎1 dpf时ofd1的WISH。对照MO、ik MO和ik MO/ik mRNA共注射胚胎1dpf时原肾的放大图。标尺,100 μm
接下来,为了确定ofd1是否可以挽救ik突变体中的纤毛病表型,我们分析了共注射ofd1 mRNA的ik突变体的表型(图5A)。正如预期的那样,与ofd1 mRNA共同注射的ik morphants显示出73.7%的WT体曲率,而ik morphants为4%,正常耳石表型为82.6%,而ik morphants为54.8%。此外,在共注射ofd1 mRNA的ik morphants中,囊肿形成率约为53%,而在共注射ofd1 mRNA的ik morphants中,囊肿形成率降至21.4%。这些结果表明ofd1是ik的下游靶点。为了排除共注射ofd1 mRNA的脱靶效应,我们使用WISH实验检测了ik morphants中ofd1的空间表达以及共注射ofd1 mRNA的ik morphants(图5B)。在援救实验中,过表达的ofd1 mRNA增强了ik变异体中ofd1表达的下调,表明无脱靶效应。基于共注射ofd1 mRNA的ik变形体肾囊肿形成的挽救表型,我们推断ofd1 mRNA共注射ik变形体也会减轻肾脏发育或囊肿形成的损害,并影响foxj1a的表达。因此,通过WISH实验和RT-PCR评估foxj1a的表达(图5C, D)。因此,在WISH中共注射ofd1 mRNA可以缓解ik变形体肾原细胞中foxj1a表达的显著上调(图5C)。RT-PCR中foxj1a的mRNA水平分析也显示了类似的结果(图5D)。这些结果表明,纤毛病表型在ik的损失是由损失的ofd1。
图5
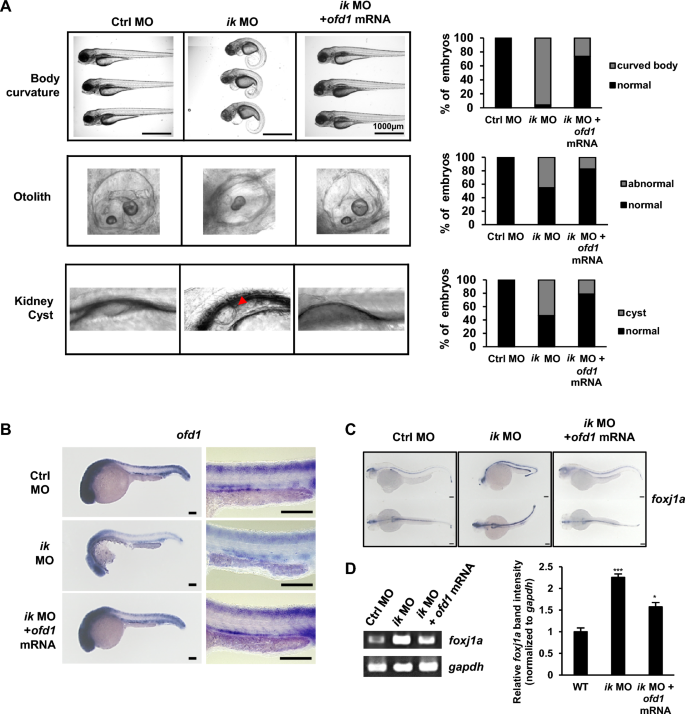
ofd1共注射挽救了ik突变体的纤毛病表型(A)对照MO、ik MO和ik MO/ofd1 mRNA共注射胚胎的侧位形态学视图(体曲率和耳石在2 dpf成像,肾原囊肿在3 dpf成像)。肾原囊肿以红色箭头表示。堆叠柱状图显示胚胎的表型百分比。对照MO、ik MO和ik MO/ofd1 mRNA在1dpf时共注射胚胎中ofd1的WISH。标尺,100 μm。对照MO、ik MO和ik MO/ik mRNA共注射胚胎1dpf时原肾的放大图。标尺:150 μm。对照MO、ik MO和ik MO/ofd1 mRNA在2.5 dpf时共注射胚胎中foxj1a的表达。比尺,100 μm (D) RT-PCR分析1.5 dpf时对照MO、ik MO和ik MO/ofd1 mRNA共注射胚胎中foxj1a mRNA的表达。Gapdh作为归一化控制。foxj1a相对于gapdh强度归一化的相对波段强度使用Image J软件图形化表示(在三个单独的实验中)。*p < 0.05, ***p < 0.001
最后,为了阐明ik和ofd1在纤毛发生中的相关性,我们使用Tg(brn3c:GFP)斑马鱼系检测了共注射ofd1 mRNA的ik变异体的纤毛形态。正如预期的那样,与ik变形体相比,共注射ofd1 mRNA的ik变形体在毛细胞中显示出恢复的纤毛长度和束数。它还显示内耳的毛细胞数量与对照变形组相当(图6A)。同样,在原肾纤毛的免疫染色中,通过共注射ofd1 mRNA, ik变形体随机无序的纤毛形态主要得到恢复(图6B)。综上所述,ik通过调节d1有助于体内正常的纤毛发生。
图6
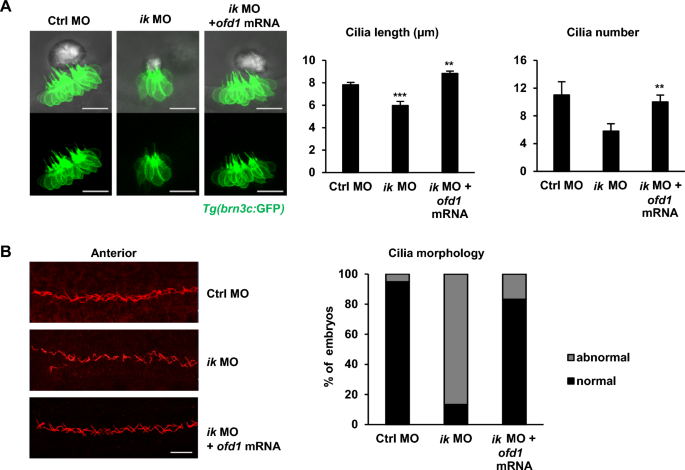
ofd1共注射可挽救ik变形体纤毛畸形(A)对照MO、ik MO和ik MO/ofd1 mRNA共注射Tg(brn3c:GFP)胚胎2 dpf时的共聚焦显微镜图像。比例尺,20μm。柱状图显示了对照MO、ik MO和ik MO/ofd1 mRNA共注射胚胎在2 dpf时内耳纤毛长度和数量的量化。**p < 0.01, ***p < 0.001 (B)使用抗乙酰化-α-微管蛋白(红色)对2 dpf对照MO、ik MO和ik MO/ ofd1 mRNA共注射胚胎的肾原纤毛进行全载免疫染色。比例尺,20μm。堆叠柱状图显示前肾前管胚胎纤毛形态百分比(胚胎纤毛形态异常百分比:对照MO, 5.12% (37/39);像MO, 86.6% (4/30);ik MO + ofd1 mRNA, 16.6% (15/18)
摘要。
背景
结果
讨论
结论
材料与方法
数据和材料的可用性
缩写
参考文献。
致谢。
作者信息
道德声明
# # # # #
纤毛病是由纤毛的功能和结构异常引起的[41]。在过去的二十年中,通过对动物模型和人类的遗传分析,揭示了与纤毛病相关的基因功能[42,43]。尽管187个纤毛病相关基因直到最近才被确定,但241个候选基因在纤毛功能中的作用仍不清楚[11]。这些候选基因的功能仍有待阐明,以了解纤毛病的病理生理。在这项研究中,我们发现ik1基因的敲低可诱导纤毛病表型,并伴有纤毛病相关基因d1的下调。
一般来说,未能对齐心血管系统的LR不对称侧通常被认为是纤毛病的主要特征[44]。然而,ik突变体在心血管系统中显示正常定位的LR环(图1C)。我们对这一现象提出了两种可能的解释。首先,这可以通过胚胎发生过程中ik的表型表达来解释。由于胚胎转录本在胚胎发生早期处于静止状态,母体提供的蛋白质和RNA直接促进了胚胎早期发育[45,46,47,48]。然后,当胚胎进入MZT期时,激活的合子基因组产生的转录因子受到基因表达程序的控制。我们观察到ik转录本在早期被检测到,但表达水平明显弱于受精卵时期(图1A)。因此,考虑到LR不对称模式出现在体细胞早期阶段[49],早期ik敲除不会影响早期胚胎发生时的表型特征。其次,已知foxj1是早期胚胎发生时LR体不对称所必需的[50]。考虑到foxj1a在ik突变体中的表达明显高于WT胚胎,foxj1a可能在ik缺失的情况下发挥互补功能。为了了解ik在体内纤毛发生中的确切作用,需要进一步研究ik在胚胎发生过程中的时空效应。
了解特定小管段纤毛细胞类型,有助于了解纤毛与肾脏发育之间的关系[37,51]。我们的研究还表明,ik突变导致原肾纤毛形态异常,但有趣的是,它仅局限于近端肾小管,而不是远端肾小管。此外,我们在ik突变体中观察到PCT和PST片段的结构异常发育(图3A)。在几乎所有脊椎动物中,存在两种主要的纤毛细胞:单个不活动的初级纤毛细胞和mcc[52]。虽然与原发性纤毛缺陷相关的纤毛病综合征已经得到了广泛的研究,但由于纤毛细胞位于器官深处,并且难以监测其行为,因此对纤毛细胞的研究在实验上受到了挑战。然而,斑马鱼胚胎具有光学透明性;因此,它们已被用作研究mcc的有力模型。在斑马鱼中,mcc存在于多种组织中,包括原肾[53]。在肾原中,mcc主要分布在PST区,但在PCT和DE段内也相邻。鉴于杂乱无章的纤毛细胞仅在ik突变体的PCT和PST中观察到,ik的缺失可能会特异性地损害近端小管中mcc的增殖或分化。有趣的是,人体临床研究也显示了类似的结果,肾脏疾病患者有异常的mcc,具有中央微管对(9 + 2结构),而健康人只有9 + 0结构的无运动初级纤毛[54,55],特别是在近端小管中,而不是在远端小管中[56]。这些结果提示mcc向近端小管细胞的异常分化可能在体内特异性影响肾相关性纤毛病。鉴于ik突变体具有与人类肾脏患者相似的表型,利用ik突变体研究ik的作用将阐明人类肾脏纤毛病的分子细节。
OFD I型综合征是一种罕见的纤毛病;然而,全球有700多万患者有肾囊性疾病及其他并发症的症状[57]。由于目前尚无有效的药物治疗OFD综合征,因此需要更多的生物学和治疗方法。在这里,我们发现ik突变体降低了d1 mRNA的表达。由于IK在体外也被称为前mrna剪接因子,我们进一步证明了是否存在ofd1的前mrna剪接损伤,但IK突变体中ofd1的下调并非来自前mrna剪接错误(附加文件5)。基于这些结果,有两种可能解释ofd1表达下调的原因。首先,它可能是ik突变体中ofd1转录因子缺陷的结果。虽然我们在本研究中通过体外IK突变体构建的拯救实验清楚地证明了IK在转录水平上直接促进OFD1的表达(附加文件4:图S4),但OFD1的特异性转录因子尚未确定。因此,有必要对ofd1基因的具体转录机制进行研究。其次,我们之前报道过ik的敲低导致基因组不稳定,在体外表现出异常的染色体特征[58]。因此,即使在体内,ik的缺失也可能导致基因组不稳定,从而导致ofd1 mRNA表达的减少。最近的报道也进一步支持了这种可能性,SMU1是IK的相互作用因子,并通过相互稳定作为一个单位起作用,导致染色体异常,姐妹染色单体交换异常[59]。他们指出,这些剪接因子的缺陷可能会破坏RNA代谢和基因组重组之间的联系,从而导致基因表达异常。因此,探讨ik缺失与染色体不稳定性之间的关系,阐明ofd1的调控机制是值得研究的。在ofd1介导的潜在分子机制中,ofd1通过促进unc-51样激酶ulk1复合物组分atg13的降解来抑制自噬[60,61]。因此,由于ofd1缺失而稳定的ulk1复合物增强了自噬,导致了OFD I型综合征。由于ofd1的表达在导致纤毛病表型的ik缺失中下调,因此需要进一步的实验来确定ofd1的缺失是否会增强ik突变体的自噬。众所周知,IK通过有丝分裂激酶调节有丝分裂细胞周期进程[16,17,18],纤毛发生依赖于自噬控制下的细胞周期进程,了解IK和OFD1之间的纤毛发生-细胞周期-自噬的相互作用将为理解人类纤毛病提供另一个分子层面。
总之,本研究首次证明了ik在体内纤毛发生中的作用。在缺乏ik的情况下,斑马鱼胚胎表现出各种纤毛病表型,纤毛组织中纤毛形态异常。我们还指出,纤毛发生的重要基因ofd1是ik的下游靶点。阐明ik的确切作用为理解体内纤毛发生和纤毛病提供了有价值的见解。
本研究采用斑马鱼(Danio rerio) WT AB*、Tg(brn3c:GFP)和Tg(bactin2:Arl13b-GFP)。Ik突变斑马鱼胚胎以前也有过描述[20]。胚胎/幼虫在28.5℃下饲养,为成年斑马鱼的自然产卵。将斑马鱼饲养在一个水箱架系统中,该系统具有自动水循环、换水、监测和调整水参数的功能。鱼在14小时的光照和10小时的暗循环下饲养,每天三次喂食青蒿(比利时INVE水产养殖)和粒状干粮(利乐,美国弗吉尼亚州布莱克斯堡)。胚胎用0.2 mg/ml三卡因(3-氨基苯甲酸乙酯)麻醉;Sigma-Aldrich,圣路易斯,密苏里州,美国)和嵌入甲基纤维素。所有的斑马鱼饲养和实验方案都符合机构指南,并得到了当地伦理委员会(Sookmyung Women 's University Animal Care and Use Committee, SMWU-IACUC-1712-036)的批准。
人视网膜色素上皮细胞系hTERT-RPE1保存在添加10% FBS (Gibco, USA)的DMEM/F12培养基中,加湿37°C, 5% CO2。使用Lipofectamine RNAiMax转染试剂(Invitrogen, USA),按照制造商的方案,用siRNA寡核苷酸(5 ' - CUACCAAGGAGUUGAUCAA-3 ')将IK siRNA转染到RPE1细胞中48小时[58]。为了敲除AURKA和AURKB,使用ON-TARGET + SMART pool (Dharmacon)的siRNA,并按照制造商的方案进行转染。在救援实验中,克隆到pcDNA 3.1载体(美国Invitrogen公司)的野生型全长人IK或突变型IK T485A,使用X-tremeGENE HP DNA转染试剂(德国罗氏公司),按照制造商的方案重新转染到siRNA转染的细胞中24小时。
根据制造商的说明,使用TRIzol (Ambion, Foster City, California, USA)提取总RNA。使用NanoDrop (Thermo Fisher Scientific, Waltham, Massachusetts, USA)检测RNA浓度,并使用Goscript逆转录系统试剂盒(Promega, Madison, Wisconsin, USA)将2 μg RNA样本反转录成cDNA。
RT-PCR引物序列采用国家生物技术信息中心(NCBI)引物blast程序(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计(附加文件7:表S1)。
如前所述,WISH采用标准方案进行[62,63]。将斑马鱼胚胎用4%多聚甲醛在4°C的磷酸盐缓冲盐水(PBS)中固定过夜,然后用PBST (137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4, 2 mM KH2PO4, 0.1% Tween 20)冲洗,重新水化。为了提高RNA探针的通透性,根据胚胎的发育阶段,用蛋白酶K (10 μg/ml)孵育胚胎。胚胎在25℃下用4%多聚甲醛固定20 min,在含有50%甲酰胺、5 × SSC (SSC: 3 M NaCl和0.3 M柠檬酸钠,pH 7)、50 μg/ml肝素、500 μg/ml RNA、46 mM柠檬酸,pH 6和0.1% Tween 20的杂交液(HYB溶液)中进行预杂交,在65℃下至少杂交1 h。除去HYB溶液,将RNA探针加入到65℃的胚胎中,孵育过夜。用50%甲酰胺在2 ×、1 ×和0.2 × SSC中,于65°C洗涤30 min 1次。为了染色,胚胎用阻断液[2%羊血清,2 mg/ml牛血清白蛋白(BSA)在PBST中]孵育2小时,然后用抗地高辛Fab片段与碱性磷酸酶结合(Roche, Penzberg,德国)在4°C下以1:50 000稀释过夜。胚胎用PBST洗涤,并用BM紫(Roche)作为碱性磷酸酶底物进行可视化。在达到足够的染色强度后,加入PBST停止反应。图像使用韩国基础科学研究院的徕卡DVM6数码显微镜(德国徕卡)拍摄。用于RNA探针的引物见附加文件8:Table。S2和foxj1a引物按照前面的描述设计[64]。
为了对斑马鱼胚胎进行纤毛免疫染色,将胚胎用4%多聚甲醛在4°C下固定过夜,用阻断液(1 × PBS, 3% BSA和1% Triton X-100)在RT下阻断2小时。斑马鱼胚胎用抗乙酰化-α-微管蛋白(Proteintech, CL594-66200, 1:500稀释)在4°C下孵育过夜。接下来,胚胎在PBST(含1% Triton X-100)中洗涤30分钟,并与Alexa Fluor 488结合的二抗(Sigma, 1:500稀释)在4°C下孵育过夜。用4',6'-二氨基-2-苯基多利(DAPI)染色固定胚胎细胞核。图像是在淑明女子大学慢性和代谢疾病研究中心使用共聚焦显微镜(LSM700,蔡司,Oberkochen,德国)获得的。
免疫印迹如前所述[20]进行。用于免疫印迹的一抗为:兔多克隆抗ofd1 (Proteintech, 22851-1-AP),小鼠单克隆抗β-actin (Santa Cruz, sc-47778),兔单克隆p-AURKA Thr288 (Cell Signaling, #3079)和兔单克隆p-AURKB Thr232 (Cell Signaling, #2914)。
胚胎用含有2%戊二醛和2%多聚甲醛的Karnovsky固定液在4°C下整片固定过夜。用0.05 M的羧酸钠洗涤三次后,用1%的四氧化锇水固定。然后,用0.5%醋酸铀酰水对胚胎进行整体染色,并通过分级系列(30-100%)乙醇脱水,每步20分钟。胚胎用溶解在乙醇中的逐渐浓缩的环氧丙烷孵育,并用浓度越来越高的斯珀尔树脂浸润。样品包埋在Spurr的树脂中,在65°C的烤箱中烘烤过夜,并使用超微切片机(EM UC7, Leica, Wetzlar, Germany)进行切片。在NICEM透射电子显微镜实验室(首尔国立大学,首尔,大韩民国)使用TEM (Talos L120C, FEI,捷克共和国)观察切片。
ik的MO序列为5 ' -GGAGCCAGAGGATTAGAGTACACAT-3 ',如前文所述[20],从GeneTools (Corvallis, OR, USA)获得。为了抑制ik,使用PV820气动PicoPump (World Precision Instruments, Sarasota, Florida, USA)向单细胞期胚胎注射4 ng MO,并在E3培养基(5 mM NaCl, 0.17 mM KCl, 0.33 mM CaCl2, 0.33 mM MgSO4和0.1%亚甲基蓝)中培养,温度28.5°C。使用显微镜(Olympus, Biotek Cytation 5)和共聚焦显微镜(LSM700,蔡司,Oberkochen,德国)捕获图像。对于救援实验,根据制造商的说明,使用T7 mMESSAGE mMACHINE试剂盒(Ambion, Foster City, California, USA)体外转录全长ik或ofd1 mRNA。然后将胚胎与每个卵共注射250 pg ik或ofd1 mRNA和4 ng ik MO。
我们使用先前分析的ik突变体的RNA-seq数据集来评估差异表达基因(DEGs)[20]。简而言之,eBiogen(首尔,韩国)分析了3 dpf时斑马鱼胚胎的全基因组RNA-seq数据。确定吸光度> 1.8,完整性> 7.0的RNA。使用每千碱基转录物每百万映射读取(FPKM)片段来确定基因表达。使用ExDEGA程序(EBIOGEN Inc., Seoul, Republic of Korea)鉴定上调或下调的基因。通过QuickGO (https://www.ebi.ac.uk/QuickGO)进行DAVID分析的基因本体(GO)。根据GO分析,使用多重实验查看器软件程序v.4.9制备deg的热图剖面。在ik - KO胚胎中,红色表示> 1.5倍变化的基因集,蓝色表示< 1.5倍变化的基因集。
图中的数值以均数±标准差(SD)表示。使用单因素方差分析(ANOVA)进行组内的多重比较,使用学生t检验评估个体组均值之间的差异。p值< 0.05为显著性差异的阈值(*p < 0.05, **p < 0.01, ***p < 0.001),并在图例中给出。
ccDownload: /内容/ pdf / 10.1186 / s13578 - 023 - 01146 - 9. - pdf
为您推荐:
- Bayraktar TB3无人机使用滑跃进行首次飞行测试 2025-10-13
- 伍尔弗汉普顿的巨大新仓库现在正在运行,零件公司瞄准“英超联赛” 2025-10-13
- 卡塔尔确保所有居民的健康权:Al Kuwari 2025-10-13
- CE认证简介 2025-10-13
- 报道:高塔姆·辛哈尼亚的离婚大战升温,妻子要求75%的财产 2025-10-13
- 泽连斯基:几名受伤的朝鲜士兵被乌克兰俘虏后死亡 2025-10-13


