着丝粒不再被认为是沉默的。着丝粒转录和周中心转录都已被发现,它们的RNA转录物最近在许多单中心模式生物中被表征并探讨了其功能。在这里,我们将讨论着丝粒转录研究中由于着丝粒和中心周围区域的重复性质和序列相似性而面临的挑战。各种技术突破有助于解决这些挑战,并揭示着丝粒和周着丝粒的独特特征。我们将简要介绍这些技术,包括第三代长读DNA和RNA测序,蛋白质-DNA和RNA -DNA相互作用检测方法,以及表观基因组和核小体作图技术。有趣的是,一些新分析的基于重复体的全新中心粒也类似于单中心粒的结构和转录行为。我们将总结支持转录过程和延迟功能的证据,以及支持着丝粒rna和着丝粒rna功能的证据。着丝粒和近丝粒rna加工成多种变体及其不同的结构也可能为其功能提供线索。未来的研究如何解决特定着丝粒转录步骤,加工途径和转录本本身的功能分离也将被讨论。
从历史上看,着丝粒通常被认为是在细胞分裂过程中“容纳”x形姐妹染色单体的狭窄区域(Flemming 1880)。在功能上,着丝粒是染色质区域,着丝粒复合体建立在此,将染色体连接到从着丝体发出的微管上。着丝粒确保姐妹染色单体和同源染色体在有丝分裂和减数分裂期间分别与子细胞均匀分离。染色体分离错误会导致染色体断裂或遗传物质的获得或损失(Potapova & Gorbsky 2017)。其后果通常对细胞和整个生物体都是灾难性的,例如不育、染色体异常疾病或癌症的异常增殖(Santaguida & Amon 2015;Smurova & De Wulf 2018)。
着丝粒的保守功能与真核生物中着丝粒不同的DNA序列、大小甚至结构相矛盾,这种现象被称为“着丝粒悖论”(Henikoff et al. 2001)。着丝粒有两种主要结构:单着丝粒和全新着丝粒(Wong et al. 2020)。单着丝粒是真核生物中最常见的着丝粒结构,其中染色体的单个区域被指定为着丝粒功能。单着丝粒可进一步分为区域和点单着丝粒。区域单中心粒的大小从千碱基到兆碱基不等,主要由富含at的DNA组成(Baker & Rogers 2005;Barbosa等人,2022),串联重复序列,称为卫星,或转座因子,在许多模式生物中观察到,包括裂变酵母,拟南芥,水稻,苍蝇,青蛙,鸡,小鼠,灰袋鼠和人类细胞(Hartley & O 'Neill 2019;Shannon M McNulty & Sullivan 2018)。区域单着丝粒的核心着丝粒区两侧是有丝分裂和减数分裂还原分裂过程中对姐妹染色单体或同源染色体的内聚起重要作用的异色区。在Pisum和Lathyrus物种中观察到,元多着丝粒是单着丝粒,它们具有不同的着丝粒区域,据信这些着丝粒一起起作用,形成一个细长的初级收缩(Schubert et al. 2020)。点单中心粒是指出芽酵母中的短着丝粒,如Saccharomyces cerevisiae中的~ 125 bp,由3个保守元件(CDEI, II和III)组成,其中CDEI富含at,而CDEI和III是回文,但不重复(Clarke & Carbon 1980)。在一些植物、昆虫和线虫中观察到着丝粒沿有丝分裂染色体的长度扩散的全新着丝粒。全新中心粒可以在着丝粒特异性卫星家族(称为Tyba)和着丝粒逆转录转座子(CRRh)上形成,如在青春期柔丝虫(Marques et al. 2015)中观察到的那样,或者在非重复序列上形成,如在秀丽隐杆线虫(Caenorhabditis elegans)中观察到的那样(Gassmann et al. 2012;Talbert & Henikoff 2020)。值得注意的是,在动物和植物谱系中,全新中心体已经从它们的单中心体祖先独立进化了多次(Escudero等人,2016;Melters et al. 2012)。
着丝粒DNA的早期突变研究(Carbon & Clarke 1984;Cumberledge & Carbon 1987),着丝粒失活(Ishii et al. 2008;Thakur & Sanyal 2013),以及新着丝粒的发现,新着丝粒是在非着丝粒DNA位点上形成的新着丝粒(Scott & Sullivan 2014;Williams et al. 1998)的研究表明,着丝粒DNA对于着丝粒的功能来说既不是必要的,也不是充分的,这就提出了大多数着丝粒受表观遗传调控的建议(Allshire & Karpen 2008)。一个例外是酿酒酵母的点单着丝粒,因为CDEIII的突变会导致着丝粒和着丝点功能障碍(Carbon & Clarke 1984;Ng et al. 1986)。包括酿酒酵母在内的许多物种含有着丝粒特异性组蛋白H3变体CENP-A,该变体取代着丝粒组装的核心着丝粒中的标准H3 (Ali-Ahmad等人,2020;Kixmoeller et al. 2020)。虽然也有例外,如家蚕(Senaratne et al. 2021)和着丝质体(Ishii & Akiyoshi 2022)中没有CENP-A,但它们分别具有组蛋白样的CENP-T和非常规的KKT蛋白。对着丝粒表观遗传调控的理解始于组蛋白变体CENP-A,但后来也包括独特的着丝粒组蛋白修饰组合,不同于常染色质和异染色质,DNA甲基化模式,着丝粒和周中心转录,着丝粒和周中心rna (cenRNAs和pericenRNAs) (Arunkumar和Melters 2020;Bergmann et al. 2012;Chan et al. 2012;Corless et al. 2020;Perea-Resa & Blower 2018;Saffery et al. 2003;Wong et al. 2007)。
单着丝粒的染色体收缩位点最初被认为是一个转录惰性位点。在出芽酵母(Hill et al. 1987)和人类人工染色体研究(Molina et al. 2016)中,高水平的转录与着丝粒功能不相容。然而,在过去的十年中,更多的证据来自于对单着丝粒的大量研究,甚至是对酿酒酵母中最简单的点着丝粒的研究(Hedouin et al. 2022;Ling & Yuen 2019;Ohkuni & Kitagawa 2012)的研究表明,核心着丝粒区域和侧翼的中心周围区域都以相对较低的水平和细胞周期依赖的方式被RNA聚合酶II (RNA Pol II)转录(Duda et al. 2017;Perea-Resa & Blower 2018;Smurova & De Wulf 2018)。中心体rna在着丝粒、内着丝粒(姐妹染色单体之间的区域)和着丝粒上的功能最近得到了全面的综述(Corless et al. 2020)。在不同的生物体中,cenRNA表达与细胞周期中CENP-A加载时间之间的关系也得到了详细的讨论(Perea-Resa et al. 2018)。
在这里,我们将重点讨论与研究着丝粒转录相关的当前挑战和最新突破,包括着丝粒DNA序列的重复性,在某些物种中区分着丝粒和着丝粒序列及其相应的转录的困难,以及将着丝粒转录过程的功能与着丝粒RNA转录物分离的困难。
摘要
介绍
挑战
未来的视角
数据可用性
参考文献
致谢
作者信息
道德声明
相关的内容
搜索
导航
#####
重复问题已经被详细讨论过(Corless et al. 2020)。将rna定位到独特的位置将依赖于完整、可靠的基因组DNA参考。最近的研究,基于第三代长读DNA测序,如Nanopore和PacBio单分子实时(SMRT)测序,分别使用细菌人工染色体(BAC)载体或完整的包体鼹鼠(CHM)衍生的单倍细胞系,从端粒到端粒组装和修饰了个体人类染色体Y和X (Jain et al. 2018;Miga等人,2020;Nurk et al. 2022)。基于这些框架,Miga的团队还揭示了着心卫星阵列的组织和进化模式(Altemose et al. 2022a)。人类巨酶大小的着丝粒中的着丝粒和近着丝粒卫星占基因组的6% (Altemose et al. 2022a)。除了由171 bp单体组成的主要部件α -卫星外,还订购了其他卫星(如HSat2、HSat3、HSat1、β -卫星)。不同的单体亚型(如a、b和c)连接并重复形成高阶重复(HOR)单元(如abc)。相同的HOR单元然后由数千个HOR单元组成一个大的,同质的HOR阵列(例如,abc-abc-abc…)。以前混淆的来自不同染色体(例如,Chr1、5、19)的着丝粒现在可以基于不同的HOR阵列和染色体特异性序列变异来解决,并通过流式细胞术分类的染色体进行验证。这项开创性的工作与直接RNA长读测序(Jiang et al. 2019)一起,开辟了新的途径,可以更精确地将长链非编码中心RNA映射到着丝粒。
在一项详细的生化研究中,通过结合CENP-A/B/C的CUT&RUN(靶下切割和使用核酸酶释放)和盐分离,Henikoff的研究小组观察到,在属于同一α -卫星亚家族的α -卫星二聚体上,CENP-A/B/C的结构存在巨大差异,序列差异仅为4-12% (Thakur et al. 2018)。构型包括对称配合物,在二聚体的两个单体上具有相等的CENP-A/B/C结合,或者不对称配合物优先占据二聚体的一个单体(Thakur et al. 2018)。这一结果表明,即使是轻微的α -卫星序列差异也会影响相关着丝体复合物的结合行为(Thakur et al. 2018)。他们的工作可能有助于我们根据cenrna的序列将CENP-A占用或染色质状态与cenrna联系起来。
另外,从具有独特序列的着丝粒中提取的工作已经避免了重复问题,并为着丝粒转录提供了证据。例如,一些鸡和土豆的染色体含有重复的着丝粒序列,而另一些则没有(Gong et al. 2012;Shang et al. 2010)。有趣的是,在鸡减数分裂II前期,着丝粒转录仅在非重复着丝粒上观察到(Krasikova et al. 2012)。在致病性白色念珠菌中,每个着丝粒都有一个独特的中心核心(Sanyal et al. 2004)。白色念珠菌的非异色中心周围区域包含长末端重复序列(LTR)、反向重复序列或非重复序列(freire - ben
等人,2016)。这种染色体特异性的着丝粒序列和组织可能有助于将来对着丝粒rna的鉴定。在S. cerevisiae中,已检测到16条染色体对应的着丝粒转录本,但它们在S期的表达量更高(Hedouin et al. 2022;Ling & Yuen 2019;Ohkuni & Kitagawa 2012)。PacBio SMRT基于探针富集的靶向RNA异构体长读测序(Iso-seq)已经能够识别许多具有链特异性和共或转录后加工信息的着丝粒(和周中心)RNA变体,例如聚腺苷化尾部(Hedouin et al. 2022)。而每条染色体的着丝粒转录本水平不同(Hedouin et al. 2022;Ling & Yuen 2019),所有染色体的着丝粒转化为相同的着丝粒DNA序列表明,着丝粒转录物的水平大致与基因组中特定着丝粒DNA序列的拷贝数相关,并且它们可能在反式中起作用,可能靠近着丝粒簇(Jin et al. 1998;Ling & Yuen 2019)。
在人类中,α -卫星序列构成了核心着丝粒和大部分侧翼的近中心区域。由于这两个区域的相似性,长期以来很难区分来自这两个区域的转录本。对长读DNA测序和现有天然(非交联)染色质免疫沉淀的分析,随后的DNA测序(N-ChIP-seq)和CUT&RUN数据集表明,只有一小部分人类α -卫星HOR单元结合CENP-A并组装着点体蛋白,被称为“活性”阵列(340 kb至4.8 Mb) (Altemose等,2022a)。侧翼的近中心“非活性”阵列包括更多分散的α卫星,其他重复族和转座元件。有分层扩展的证据,新的,独特的α -卫星重复出现,并在阵列内扩展成为着丝点组装的位置(有源阵列),而旧的重复序列则对称地侧向移位,成为无活性的周中心“层”。然而,在更新或旧的重复序列上的CENP-A定位也存在个体差异,这表明表观遗传可塑性。
鉴定大的结构重排、转座元件或中心周围区域的基因散布也有助于染色体之间的区分(Altemose等,2022a),并可能有助于转录的中心rna或中心周围rna的注释。在未来,允许分析具有长读信息的蛋白质-DNA相互作用的技术,如DiMeLo-seq,将有助于破译着丝点功能与潜在DNA序列、个体变异和进化趋势之间的关系(Altemose et al. 2022b),并与长读RNA进行比较。
除了新发现的人类着丝粒区和近中心区α -卫星HOR差异外,研究人员还通过显微镜方法阐明了这两个区域的染色质环境存在显著差异。例如,核心着丝粒的染色质通常包含与开放染色质或许可转录相关的组蛋白修饰标记(Bergmann et al. 2012;Bergmann et al. 2011;Gopalakrishnan et al. 2009;Sullivan et al. 2004)。核心着丝粒内的CENP-A核小体散布着典型组蛋白H3核小体,其中H3尾部被H3K4me1、H3K4me2、H3K36me2和H3K36me3修饰(表1)。这些修饰对于CENP-A伴侣、HJURP、靶向和CENP-A组装是必不可少的(Bergmann et al. 2011;Duda et al. 2017)。H3K4me2是一种与开放但不活跃的常染色质相关的修饰(Sullivan et al. 2004;Soares et al. 2017)。H3K36me2富集于转录起始位点下游(Weinberg et al. 2019),并可募集组蛋白去乙酰化酶(HDAC)酶(Li et al. 2009)。核心着丝粒也有减少的CpG甲基化,称为着丝粒倾斜区(CDR),与其开放的染色质一致(Altemose et al. 2022a)。
表1 Trans核心着丝粒和中心粒上与转录相关的“组蛋白编码”
在人类人工染色体(HACs)上,核心着丝粒转录可以促进H3K9ac的积累,从而阻止该区域异染色质的形成(Molina et al. 2016)。然而,在同一位点上,通常被认为与转录抑制有关的H3K9me3也被证明与着丝粒核小体兼容(Bergmann et al. 2012;Ribeiro et al. 2010)。然而,一般来说,核心着丝粒缺乏明确的异染色质标记,如H3K9me2 (Sullivan et al. 2004)。核心着丝粒区域的常染色质和异染色质特征之间的平衡是维持着丝粒转录低水平、维持着丝粒同一性和形成活跃着丝粒所必需的(Sullivan et al. 2004)。另一方面,中心周围区域的组蛋白修饰通常与转录沉默相关,如H3K9me2、H3K9me3、H3K27me2和H3K27me3(表1)(Gopalakrishnan et al. 2009;Kundaje et al. 2015)。
在中心着丝粒,组蛋白H4尾部也被修饰。在鸡细胞中,与转录染色质相关的H4K5ac和H4K12ac被发现在核心着丝粒CENP-A前核小体中富集,并且对CENP-A沉积至关重要(Shang et al. 2016)。与转录激活相关的H4K20me存在于鸡和人的CENP-A核小体中,是着丝粒组装的先决条件(Bergmann et al. 2011;Hori et al. 2014;Sullivan et al. 2004)。
对于可以区分着丝粒和近心粒DNA序列的生物体,可以分别分析转录本的水平和功能。例如,在S. pombe中,核心着丝粒CENP-A/ cnp1包含区域由非重复的中央核心(cnt)和侧翼的最内层重复(imr)组成。通过tRNA阵列将核心着丝粒与中心外重复序列(otr)分离(Dawe 2003)。有证据表明,RNA Pol II以不同的长度、水平和功能表达cnt、imr和其他r。屏障处的tRNA基因也通过RNA Pol III表达。中心周围rna被加工成小干扰rna (sirna),这对异染色质的建立至关重要,而异染色质的建立又需要在引入的含着丝粒质粒上重新建立CENP-A (Folco et al. 2008)。有趣的是,系住组蛋白H3赖氨酸9甲基转移酶Clr4来合成异染色质可以绕过RNA干扰(RNAi)和外部重复序列的存在来建立着丝粒(Chan & Wong 2012;Kagansky et al. 2009)。
酿酒链球菌不具有异色的中心周围区域,但中心周围区域以H2A为特征。含有z的核小体,其中已知这种H2A变体调节姐妹染色单体内聚和基因表达(Giaimo等人,2019;Sharma et al. 2013)。事实上,着丝粒转录主要通过具有高度异质转录起始位点(TSS)的着丝粒周围区域进行读取,但很少跨越整个着丝粒(Hedouin et al. 2022),这与CDEI和CDEIII中的RNA Pol II停滞一致(Candelli et al. 2018)。
在果蝇中,先前的ChIP-seq显示CENP-A与简单卫星相关(Talbert et al. 2018)。然而,最近的染色质纤维、长读DNA测序和映射到富含异染色质的基因组组装的CENP-A/CID ChIP-seq显示,CENP-A染色质形成于逆转录元件G2/坐席-3上,这是所有染色体着丝粒中唯一共享的元件(Chang et al. 2019)。然后,这个核心着丝粒的两侧是大量的卫星重复序列(Chang et al. 2019)。在一些染色体的着丝粒中检测到低水平的G2/Jockey-3转录,但并非全部(Chang et al. 2019)。卫星RNA也被证明可以结合CENP-C并帮助将CENP-C定位到着丝粒上(Ro?i? et al. 2014)。精致的着丝粒和着丝粒组织将促进这两个区域的转录分离。
对进化新中心粒(ENC)的分析表明,新的cenp - a定义的核心新中心粒富含活性表观遗传标记、RNA Pol II和负超卷曲DNA,与活性转录一致。相反,抑制性表观遗传标记(例如H3K27me3)向周围区域扩散(Naughton et al. 2022)。作者认为,转录破坏染色质为着丝点形成提供了基础,而致密的近心异染色质产生了机械刚性(Naughton et al. 2022)。
除了着丝粒和中心周围序列和表观遗传差异外,最近的一项研究还通过一种新开发的单分子腺嘌呤甲基化寡核体测序法(SAMOSA)研究了不同卫星序列中的核小体模式,该方法结合了非特异性腺嘌呤(m6dA)甲基转移酶足迹和单分子实时PacBio DNA测序,以天然和非破坏性地测量核小体的位置,规律性,和单个染色质纤维上的核小体重复长度(nrl) (500 b-2 kb) (Abdulhay et al. 2020)。有趣的是,在人类K562细胞中,h3k9me3修饰的α -和β -卫星序列在预期的规则和意外的不规则纤维中都富集(Abdulhay et al. 2020)。结果表明,异染色质核小体构象可以是不规则的,也可以是异质的。另一方面,H3K9me3-free γ -satellite仅在具有规则长nrl的染色质纤维中富集(Abdulhay et al. 2020)。nrl可能指定异染色质核小体阵列相分离的能力(Gibson et al. 2019)。随着未来酶切条件的优化,SAMOSA可以应用于更长的阵列,使单分子寡核小体图谱的千碱基结构域研究成为可能。此外,在相同的单个分子上可以检测到多个生化或表观遗传信号,提供了“多组学”第三代测序平台(Abdulhay et al. 2020)。
着丝粒转录领域的一个缺失部分是它是否也发生在元多着丝粒和全新着丝粒中。对于基于重复序列的全新中心粒,最近的PacBio HiFi长读测序、ChIP-seq和高通量染色体构象捕获(Hi-C)对三个全新中心的塞草Rhynchospora物种及其最接近的单中心近亲rush Juncus effusus进行了研究,使我们能够比较它们的着丝粒和表观基因组组织以及3D基因组结构(Hofstatter et al. 2022)。CENP-A/着丝粒组蛋白H3 (CenH3)在整个微柔毛鼠和短花萼鼠基因组中Tyba重复序列的富集程度最高,CRRh的富集程度较低(Hofstatter et al. 2022)。Tyba序列的密度随着染色体的大小而降低,并且在Tyba一致序列中存在高频率的双体对称(Hofstatter et al. 2022)。在青春期红毛鼠中,结合cenp - a的Tyba卫星在所有组织中都具有转录活性,这些Tyba卫星和CRRh以全基因组穿插阵列的形式插入到具有转录活性的含基因染色质区域(Marques et al. 2015)。由于缺乏着丝粒聚集,全新中心莎草比单中心莎草具有更多的染色体内相互作用(Hofstatter et al. 2022)。这些新发现的基于重复的全新着丝粒似乎与许多区域性着丝粒有相似之处。相对于核心的CENP-A区域,CENP-A结构域侧翼的H3K9me2略微富集,类似于单中心粒的周中心点染色质组成(Hofstatter et al. 2022)。进一步的研究将阐明Tyba和CRRh转录本的行为是否分别类似于cenRNA和pericenRNA。
然而,在非重复基的全新中心体中,迄今为止还没有完整中心体转录的具体证据。在线虫秀丽隐杆线虫(Gassmann et al. 2012)和鳞翅类家蚕(Senaratne et al. 2021)中,CENP-A/HCP-3或CENP-T定位与活性转录区呈反相关。在飞蛾组织培养细胞中,激素诱导转录会导致该区域的CENP-T丢失,这表明转录可以排除全新中心粒位置(Senaratne et al. 2021)。秀丽隐杆线虫胚胎中的CENP-A不仅与胚胎中活跃转录的基因呈负相关,而且与一些种系转录区域呈负相关(Gassmann et al. 2012)。组蛋白H3K36甲基转移酶met-1突变导致H3K36me3异位定位和CENP-A的排除,但这些位点的活性RNA Pol II定位并不一定增加(Gassmann et al. 2012)。Argonaute CSR-1参与调节种系基因表达的小RNA通路(Claycomb et al. 2009)。CSR-1抗的种系靶基因位点与CENP-A定位相关(Gassmann et al. 2012)。破坏CSR-1通路会增加染色质上的CENP-A水平(Wong & Yuen 2022)。这些结果表明,活跃的或过去的基因转录、组蛋白修饰和22G-sRNA可能限制了CENP-A的定位,这与白色念珠菌和酿酒酵母的高基因表达与CENP-A的不相容性是一致的(Hill等,1987;Ketel et al. 2009)。
在几乎没有基因的秀丽隐杆线虫人工染色体(AC)上,CENP-A结构域间隔和平均结构域大小减小,表明更多的非表达区域是允许CENP-A定位的全新着丝点区域(Lin et al. 2021)。通过人工染色体成像,我们发现RNA Pol ii介导的转录抑制导致全新中心秀丽隐杆线虫早期胚胎新形成的ACs上的新生着丝粒建立延迟(Zhu et al. 2018a)。然而,我们没有探究cenRNA是否存在,也没有区分在着丝粒建立过程中转录行为与cenRNA产物的作用。到目前为止,现有的转录组分析已经检测到许多低丰度的长非编码转录本(Akay et al. 2019;Nam & Bartel 2012),但与全新染色体没有直接关系。研究全新中心转录和中心rna是否存在,以及它们与着丝粒功能的关系,将是一件有趣的事情。
在许多被分析的物种中,RNA Pol II负责着丝粒转录,这可以通过使用不同的药物来抑制RNA聚合酶I、II或III的活性来证明(Chan et al. 2012)。最近,免疫荧光实验表明,在有丝分裂过程中,苍蝇、青蛙和人类着丝粒中存在与活性转录延伸相关的c端结构域(CTD)的RNA Pol II丝氨酸2磷酸化(Blower 2016;Chan et al. 2012;Molina et al. 2016;Ro?i? et al. 2014)。RNA Pol II在着丝粒转录中的传代会带来两种作用:它可以触发染色质重塑事件和产生着丝粒RNA。因此,尽管在着丝粒上装载CENP-A与不同生物体的转录过程广泛相关(Choi et al. 2011;Grenfell et al. 2016;qunet & Dalal 2014),其潜在的分子机制才刚刚开始揭示,这可能有助于我们分离转录的两种作用。
向心反式函数但又
先前的一些研究已经在着丝粒中发现了RNA Pol ii相关蛋白和转录相关的染色质重塑因子。在真核生物中,促进染色质转录(FACT)是包含SSRP1和SUPT16H的两个亚基复合物,是RNA Pol II转录活性的主要调节因子之一。当RNA Pol II穿过FACT时,FACT可以保留在DNA上(Belotserkovskaya et al. 2003)。FACT可以通过破坏核小体的稳定或稍后刺激核小体的形成来促进RNA Pol II的延伸(Formosa 2012)。有趣的是,FACT的两个亚基在不同的生物体中都与CENP-A相互作用(Barth et al. 2014;Foltz et al. 2006),并通过与果蝇的CENP-A/CID伴侣染色体对齐缺陷1 (CAL1)相互作用,合作在核心着丝粒区域转录偶联加载CENP-A(图1A) (Chen et al. 2015)。在果蝇的异位着丝粒中,CAL1也招募FACT和RNA Pol II,这对新生的CENP-A沉积至关重要(Chen et al. 2015)。FACT的两个亚基在有丝分裂染色体的着丝点处的免疫染色最强,与此同时,CENP-A通常在果蝇组织培养细胞中负载(Mellone et al. 2011)。最近一项使用果蝇组织培养细胞的研究进一步提出了CENP-A的募集和染色质装载的两步模型:开始时,cal1相互作用的CENP-A以独立于转录的方式被募集到着丝粒结构域,CENP-A与着丝粒染色质保持松散关联,然后RNA Pol II通道促进H3核小体的交换,将CENP-A稳定地整合到着丝粒的核小体中(Bobkov et al. 2018)。然而,最近在果蝇早期胚胎发生中的另一项研究表明,RNA Pol ii介导的转录对于着丝粒上装载的CENP-A的招募不是必需的(Ghosh & Lehner 2022)。这些对比结果暗示着着丝粒转录需求的异质性,这可能取决于发育阶段或细胞类型。
图1
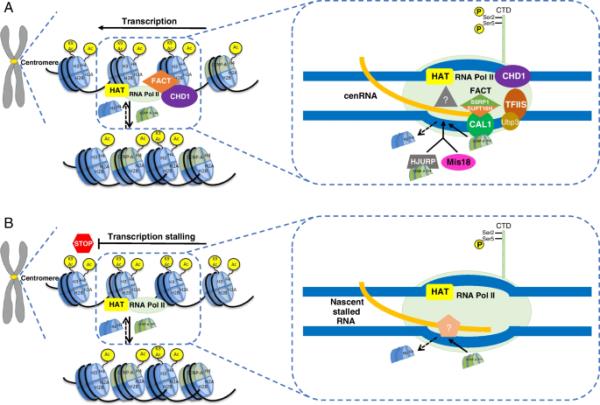
一个示意图概述了着丝粒转录和停滞如何调节着丝粒CENP-A装载。A染色质环境发生变化,RNA Pol II通道产生的“转录泡”有利于CENP-A核小体在着丝粒区域的结合。转录相关的染色质重塑因子,包括FACT复合物和CHD1,以及CENP-A伴侣如CAL1或HJURP以及MIS18,已被证明在着丝粒转录过程中对CENP-A沉积很重要。在c端结构域(CTD) Ser2磷酸化的RNA Pol II存在于着丝粒中,表明通过RNA Pol II的作用进行主动转录延伸。由SSRP1和SUPT16H亚基组成的FACT复合物的核小体不稳定活性可以通过致密染色质促进RNA Pol II的延伸,而RNA Pol II的转录可以驱动着丝粒结构域的进一步松动。FACT已被证明通过与果蝇中CENP-A装载因子CAL1相互作用而与CENP-A蛋白相互作用。FACT破坏H3核小体的稳定性,以促进CENP-A的装载。RNA Pol II转录也可以将HAT复合物招募到着丝点上,从而产生乙酰化的染色质环境,这已被证明有利于CENP-A的装载。转录延伸的未知因素也可能促进CENP-A的沉积。B RNA Pol II延迟允许重新建立CENP-A染色质。RNA Pol II的CTD七磷酸重复序列中的丝氨酸2在延长RNA Pol II时被磷酸化,并且该RNA Pol II在停滞时变得泛素化。在S. pombe中,新引入的带有核心着丝粒区域的质粒会导致RNA Pol II的短暂停滞,但可以借助TFIIS和Ubp3等因子有效清除(Kulish et al. 2001;Kvint et al. 2008;Martinez-Rucobo & Cramer 2013)。TFIIS通过在RNA Pol II停滞的情况下切割新生转录本来促进转录延伸。缺乏Ubp3或TFIIS的突变体会破坏停滞RNA Pol II的重新启动过程,导致停滞RNA Pol II复合物的积累,延长停滞时间,并导致促进CENP-A沉积的未知因子的募集。RNA Pol II失速环境导致H3核小体被有效地排出。CENP-A的n端尾部缺乏H3的保守赖氨酸残基(如K9),因此不具有h3k9ac样的修饰来辅助转录。因此,与H3核小体相比,CENP-A核小体可能具有更大的转录障碍。因此,一旦装载了CENP-A核小体,它可能会加剧转录停滞,为以自我延续的方式招募更多的CENP-A创造条件
一种合成生物学方法将不同的组蛋白修饰剂连接到人类人工染色体(HAC)上的alphoidtetO着丝粒上,以操纵着丝粒上的组蛋白修饰,从而控制着丝粒上的转录(Molina et al. 2016)。h3k9ac相关而非h4k12ac相关的转录挽救了H3K4me2和着丝粒转录的缺失(Molina et al. 2016)。因此,作者提出有丝分裂着丝粒转录和H3K9ac都可以产生适当的表观遗传景观,以破坏H3核小体的稳定并促进CENP-A的加载(Molina et al. 2016)。在鸡B细胞系DT-40中,FACT以依赖于cenp - h的方式定位于着丝粒,并与染色质重塑剂CHD1结合以促进CENP-A加载(Okada et al. 2009),这提高了CENP-A伴侣HJURP可能通过类似于果蝇CAL1的依赖于事实的机制起作用的可能性。另一方面,在出芽酵母S. cerevisiae中,FACT通过与e3泛素连接酶结合并触发蛋白酶体介导的异位CENP-A降解,从而纠正异位CENP-A负载(Deyter et al. 2014)。
除了转录伸长,核心着丝粒区域内的转录停滞被认为可以促进裂变酵母中CENP-A染色质的重新建立(图1B) (Catania et al. 2015)。S. pombe的中央核心结构域(cnt)包含许多启动子和转录起始位点(Catania et al. 2015)。碳纳米管不同部分组装CENP-A染色质的能力是不相等的。令人惊讶的是,转录活性较低的部分(高RNA Pol II水平但低转录水平)比活性较高的部分更有效地招募CENP-A。在重新启动停滞RNA Pol II方面存在缺陷的突变体确实增加了CENP-A的装载,这表明持续的RNA Pol II停滞为CENP-A装载创造了有利的染色质环境,可能是通过移除H3核小体而不排出CENP-A或为CENP-A的招募提供了更长的时间(Catania et al. 2015)。一项体外实验也表明,与H3核小体相比,CENP-A核小体具有更大的转录障碍(shandiya et al. 2014),并且CENP-A诱导的停滞可能会在正反馈循环中潜在地促进其自身的招募。
为了进一步破译转录过程中的哪一步可能对促进CENP-A和着丝点组装很重要,Heald的团队使用了不同的药物治疗来抑制非洲爪蟾的特定转录阶段。当转录起始被雷公藤甲素抑制或RNA剪接过程被ISGN抑制时,观察到CENP-A和着丝点蛋白NDC-80水平降低(Grenfell et al. 2016)。然而,当α-amanitin抑制转录延伸时,没有观察到CENP-A掺入效应(Grenfell et al. 2016)。这些结果可能表明一些转录起始因子或剪接因子特异性地参与了CENP-A的募集。
从这些研究来看,着丝粒的转录和停滞行为,伴随着转录相关的染色质重塑,在着丝粒染色质的建立和维持,特别是CENP-A稳定地结合到染色质中起着重要的作用。然而,要明确得出该功能仅来自转录过程而不是来自cenrna的结论,还需要更多的证据来区分这两种作用。
cenRNA的结构和功能
一般来说,非编码RNA可以作为将蛋白质招募到DNA或染色质的向导,组装核糖核蛋白复合物的支架,结合和隔离蛋白质从而抑制其正常功能的诱饵,或细胞间信号分子(Corless et al. 2020;Hezroni et al. 2015)。相对于对着丝粒转录过程的研究,对着丝rna水平调控的研究似乎更多。着丝粒来源的rna被认为在着丝粒形成和功能中起关键作用。具体来说,cenrna的过表达或敲低会降低着丝粒的CENP-A和CENP-C水平(Ling & Yuen 2019;Liu et al. 2015;Ro?i? et al. 2014)。然而,cenRNA序列保守性的缺乏促使我们推测cenRNA是否具有任何保守的二级和三级结构,这可能使它们能够将着丝粒蛋白招募到着丝粒中。
着丝粒转录通常发生在正链和反义链中(Ferri et al. 2009;Ling & Yuen 2019;Topp et al. 2004)。长(> 200 nt)和短(> 200 nt)非编码cenRNA和周状rna已在先前的综述中进行了编目(Arunkumar和Melters 2020;Chan et al. 2012;Chan & Wong 2012)。cenRNA结构被认为是双链RNA (ds)、单链RNA (ss)或DNA-RNA杂交,在着丝粒上有互补的DNA序列(r -环)。在这里,我们描述了支持不同类型的cenRNA结构的证据(表2)。
表2不同物种的cenRNAs结构不同
双链(ds) rna
小鼠核心着丝粒的小卫星被转录,这些转录物对切割dsRNA的RNase III敏感(Bouzinba-Segard et al. 2006)。袋鼠内源性逆转录病毒(KERV-1)以dsRNA和ssRNA两种形式存在,它们对于CENP-B的定位和中心周围异染色质的维持至关重要(Carone et al. 2009)。在Schizosaccharomyces pombe中,核糖核酸酶Dicer(将中心周围的其他dsRNA切割成21-25-nt小干扰RNA (siRNA))和RNA诱导的转录基因沉默(RITS)复合物的启动对于CENP-A/Cnp1的建立很重要(Folco et al. 2008)。
单链(ss) cenRNA
在玉米中,着丝粒反转录体(CRM)和卫星重复体(CentC)在两条链中都被积极转录,并且cenrna (40-250 nt)与CENP-A相互作用(Topp et al. 2004)。然而,没有检测到由RNAi途径加工的着丝粒来源的小干扰rna (sirna)。这些cenrna对RNase A也很敏感,这表明它们保持单链组织(Topp et al. 2004)。与双链RNA相比,单链RNA高度不稳定(Zhang et al. 2021)。然而,rna -蛋白相互作用可能会稳定ss cenRNA。进一步的体外研究表明,单链玉米cenRNA (44 nt)对于CENP-C外显子复制区维持DNA结合至关重要,并且这种cenRNA-CENP-C相互作用是CENP-C着丝粒正确定位所必需的(Topp et al. 2004)。在人HeLa细胞系中,α -卫星cenRNA、CENP-C1和cenp以依赖RNA聚合酶i的方式在间期定位到核仁上,并且这种定位对RNase A也很敏感(Wong et al. 2007)。这表明人类的着丝rna也以单链结构与着丝点或内部着丝粒蛋白相互作用。
在酿酒酵母(Saccharomyces cerevisiae)点着丝粒转录的情况下,引入RNAi机制(但不添加针对cenRNA的发夹RNA)后,cenRNA的水平不受影响,这表明内源性cenRNA可能不作为dsRNA存在(Ling & Yuen 2019)。然而,到目前为止,还没有ssRNA在出芽酵母中的直接证据。
R-loop
由于cenrna与模板着丝粒DNA高度互补,因此cenrna可以潜在地结合并形成由三链DNA-RNA混合物组成的r环结构,其中一条RNA与一条DNA链结合,以及一条移位的单链DNA。根据不同的研究,r -环被报道与基因转录相关(Fang et al. 2019;Ling & Yuen 2019)、DNA复制起始(Yu et al. 2003)、DNA损伤反应(Hamperl et al. 2017)、DNA修复(Lu et al. 2018)和基因组不稳定性(Chedin & Benham 2020)。DNA-RNA杂交体的形成也是RNA以序列特异性方式靶向局部染色质的重要途径(Maldonado et al. 2019)。
一般来说,r环是在转录过程中与富含g的簇形成的(Allison & Wang 2019)。然而,着丝粒区通常富含AT (Altemose et al. 2022a;Baker & Rogers 2005),这不利于延伸和r环的形成。此外,负超线圈有利于r环的形成(Stolz et al. 2019)。在S. cerevisiae中,CENP-A/CSE4在着丝粒处诱导正超卷曲(Furuyama & Henikoff 2009),这不利于r环的形成。然而,在转录过程中,当RNA聚合酶作用于DNA模板时,RNA聚合酶的上游存在一个超负超卷曲区域,可能会发生r环的形成(Dorman 2019)。
着丝体r -环已在不同物种中被发现,包括裂变酵母、玉米、水稻、拟南芥和人类(Fang等人,2019;Kabeche et al. 2018;Xu et al. 2017)。其中,利用S9.6抗体的DNA- rna杂交免疫沉淀,通过单链DNA连接构建文库,构建了玉米叶片全基因组R-loop图谱,并进行了测序(ssDRIP-seq)。r -环在着丝点区域富集,特别是在CENP-A/CenH3的结合区域和中心周围区域(Yang Liu et al. 2021)。
在pombe S. pericentrmeric outer repeats (otr)中,除了dsRNA (Folco et al. 2008)外,大约一半的非编码rna (ncRNAs)与对RNase H敏感的染色质相关,后者可切割DNA-RNA杂交体(Nakama et al. 2012)。这些ncrna形成DNA-RNA杂交体,与rna诱导的转录沉默(RITS)复合物结合,形成rnai驱动的异染色质组装平台(Nakama et al. 2012)。
一些证据还表明,r环的积累实际上有助于维持着丝粒的完整性。在人类细胞中,有丝分裂期间在着丝粒中检测到r环,并且r环的存在驱动ATR信号通路激活,这对于忠实的染色体分离和基因组稳定至关重要(Kabeche等人,2018)。最近的一项研究表明,在G1期诱导着丝粒双链断裂(DSBs)可导致人类和小鼠着丝粒H3K4me2和cenRNAs转录的增加。CENP-A和HJURP与去泛素酶USP11相互作用,使RAD51-BRCA1-BRCA2复合体形成。这进一步促进了DNA和RNA的同源重组(HR),尽管没有姐妹染色单体,形成DNA-RNA杂交,并导致DNA末端切除,以促进dsb的修复(Yilmaz et al. 2021)。
相反,已发现着丝粒染色质上r环的积累不利于染色体的适当分离和基因组的稳定性(Allison & Wang 2019)。在酿酒酵母中,与CENP-A/CSE4相互作用的HPR1阻止了R-loop在着丝粒区域的积累。在hpr1?突变体中,观察到CENP-A伴侣SCM3水平降低,着丝粒组蛋白H3定位缺陷增加(Mishra et al. 2021)。在人类癌细胞系中检测到着丝体α -卫星阵列r -环。R-loop的存在会招募BRCA1,从而抵消R-loop在着丝粒的积累,防止着丝粒断裂,限制超重组,并确保CENP-A的适当定位(Racca et al. 2021)。小鼠心周主要卫星RNA转录的过表达会隔离BRCA1相关网络,导致DNA复制叉的不稳定、r环的积累、DNA损伤和乳腺癌的诱导(Zhu等人,2018a, b)。在这些研究中,着丝粒r环和BRCA1的共同存在是显而易见的(Yilmaz等人,2021;Racca et al. 2021;Zhu et al. 2018a, b),根据不同的情况,后果似乎是不同的。上述研究结果表明,着丝粒r环可能对着丝粒功能和基因组稳定性有积极和消极的影响(Crossley et al. 2019)。进一步了解着丝粒r环结构如何影响着丝粒在不同物种或条件下的功能,将有助于揭示其动态作用。
着丝粒circRNA
环状RNA (circRNAs)是通过反向剪接过程融合前信使RNA (mRNA)的上游5 ' -剪接位点和下游3 ' -剪接位点而形成的(Li et al. 2018)。CircRNAs是单链、共价封闭的RNA分子,参与RNA -蛋白复合物的形成和基因表达调控(Li et al. 2018)。circrna已经在果蝇、蠕虫、小鼠、人类和植物中进行了探索,如水稻、拟南芥、玉米和小麦(Memczak et al. 2013;Salzman et al. 2012;Westholm et al. 2014;Ye et al. 2015;Chen et al. 2018;Ye et al. 2015)。然而,由于着丝粒DNA的重复性和生物信息学分析工具鉴定环状rna的局限性,鉴定着丝粒环状rna一直很困难。
第一个鉴定的着丝粒环状rna来源于玉米的着丝粒反转录转座子。这些着丝粒环状rna通过r环与着丝粒结合(Liu et al. 2020)。当使用RNA干扰靶向环状环状RNA的反剪接位点时,circRNA、R-loop和R-loop诱导的染色质环的水平降低,从而导致着丝粒定位处的CENP-A/CenH3水平下降,这表明着丝粒circRNA来源的R-loop在着丝粒完整性中的重要性(Liu et al. 2020)。这些着丝环状rna的功能和特征才刚刚开始被理解。
cenrna作为支架的功能
非编码RNA可以作为空间组织蛋白质的支架。这种rna -蛋白或RNA-RNA结合可以是可溶性或染色质相关蛋白复合物的组成部分(Hentze et al. 2018)。rna可能在可溶性复合体的形成中发挥作用(quameset & Dalal 2014)。为了鉴定rna依赖的可溶性复合物,一种基于密度梯度超离心的新开发的工具,称为R-DeeP,已经被使用。CENP-A伴侣HJURP显示出rna依赖性的大小变化(Caudron-Herger等人,2019)。HJURP复合物在RNase (RNase A、RNase I、RNase T1、RNase H和RNase III)处理后,其蛋白复合物的大小增加。作者将这种尺寸的增加归因于相互作用伙伴的增加,因为RNA降解时结合位点的可用性增加(Caudron-Herger等人,2019)。未来的研究可以确定cenRNAs是否在这种复合物的形成中发挥作用,这将有助于更完整地了解cenRNAs在可溶性蛋白复合物形成中的作用。
除了可溶性蛋白复合物外,转录的rna还可以与近端染色质结合,RNA-DNA近端连接方法证明了这一点(Bell等人,2018;Sridhar et al. 2017)。事实上,众所周知的染色质结合因子,如Polycomb复合物(Zhang et al. 2019)和ccctc结合因子(CTCF) (Hansen et al. 2019),不仅与不同的DNA基序结合,而且在功能上与RNA相关。Polycomb复合物(Davidovich et al. 2013)和CTCF (Hansen et al. 2019;Salda?a-Meyer et al. 2019)在中心外异染色质上丰富,并与对其功能至关重要的RNA组分相互作用。
着丝粒rna在着丝粒内信号传导中的作用
内着丝粒是姐妹染色单体的着丝粒区域之间的区域(Trivedi & Stukenberg 2016)。染色体乘客复合体(CPC)在着丝粒内部区域积累(Trivedi & Stukenberg 2016)。CPC含有有丝分裂激酶Aurora B、INCENP、survivin和borealin (Trivedi & Stukenberg 2016),可以感知并响应着丝点产生的拉力(Bloom 2014)。在一些脊椎动物中,CPC成分已被证明可以拉低cenrna。例如,在Xenopus中,Aurora B已被证明与cenRNA结合,后者调节Aurora B的定位和激活(Blower 2016)。Shugoshin (SGO1)在前期保护着丝粒内聚不被切割(McGuinness et al. 2005),也被证明在体外与cenRNA相关(Liu et al. 2015)。这种cenRNA-SGO1相互作用可能使SGO1达到嵌入着丝粒染色质的内聚蛋白(Liu et al. 2015)。然而,cenrna究竟是如何影响SGO1和CPC的募集以促进有丝分裂进程的尚不清楚。
圆心反式函数异染色质形成中的转录和周包膜rna
正如上文a1和3节所讨论的,裂变酵母其他周粒RNA转录本通过RNA干扰途径处理,对异染色质的建立很重要(Folco et al. 2008)。在小鼠细胞中,H3K9甲基转移酶SUV39H1和SUV39H2与来自中心周围区域的主要卫星rna相关(但不与来自着丝粒区域的次要卫星rna相关)(Camacho et al. 2017;Johnson et al. 2017)。蛋白质- rna相互作用稳定了它们的染色质定位,促进了H3K9组蛋白甲基化和异染色质形成(Camacho et al. 2017;Johnson et al. 2017)。在鸡-人杂交DT-40细胞系中,着丝粒也含有独特的DNA序列(Krasikova et al. 2012),有条件敲除Dicer对中心周围区域和核心着丝粒有不同的影响(Fukagawa et al. 2004)。rnai缺陷细胞导致异染色质蛋白、内聚蛋白Rad21和检查点蛋白BubR1的定位缺陷,而着丝粒蛋白(包括CENP-A和CENP-C)的定位正常(Corless et al. 2020;Fukagawa et al. 2004;Johnson et al. 2017)。这一结果表明这两个区域对RNA干扰或Dicer通路的需求存在差异(Fukagawa et al. 2004;Hall et al. 2002;Provost et al. 2002;Volpe et al. 2002)。
着丝粒和中心周围RNA失调与疾病的影响
cenRNA和周膜rna上调与应激、癌症和疾病的关联和后果已被调查和广泛审查(Arunkumar和Melters 2020;Hernández-Saavedra et al. 2017;Smurova & De Wulf 2018)。中心周HSAT II在一些癌症中过表达,这表明其在癌症诊断中的潜在应用(Hall et al. 2017)。过表达中心周围卫星RNA甚至可以诱发乳腺癌(Zhu et al. 2018b)。一般来说,高水平的cenRNAs促进染色体不稳定性(CIN),这与肿瘤转移相关(Chan et al. 2017;Zhu et al. 2011)。了解不同生物体如何微调cenRNA和周状rna的表达,并确定应激和疾病条件下cenRNA调控之间的关系,将有助于将cenRNA和周状rna作为癌症和其他疾病诊断或预后的生物标志物(Arunkumar and Melters 2020;Smurova & De Wulf 2018)。cenRNA或pericenRNA水平的调节也可能是重要的癌症预防或治疗。
不同的起始和结束位点,以及不同的细胞周期时间
着丝粒转录的时间因生物而异,但似乎与CENP-A装载的时间相关,如上文b1中简要讨论和先前更广泛的综述(Arunkumar和Melters 2020;Perea-Resa et al. 2018)。然而,在同一生物体中,可以在细胞周期的不同阶段观察到cenRNA变异,正如在S. cerevisiae的G1期和S期使用长读测序技术对同种异构体RNA进行测序所证明的那样(Hedouin et al. 2022)。每条染色体最丰富的转录异构体可以根据TSS进行鉴定和分类:它们可以在附近的基因启动子或终止位点启动,从邻近基因的反义起始,从邻近基因的转录读出,或在基因间区域启动(图2A) (Hedouin et al. 2022)。然而,它们通常在G1期结束于着丝粒上游(Hedouin et al. 2022;Ling & Yuen 2019)。只有在S期,由于着丝粒DNA复制和CBF1从CDEI中移除,转录漏入CDEI或CDEIII,导致cenrna的产生(Hedouin et al. 2022)。即便如此,大多数已鉴定的中心rna并不包含完整的着丝粒(所有三个cde) (Hedouin et al. 2022)。通过cDNA末端的5 '和3 '快速扩增(RACE),鉴定了来自三条染色体的正义链和反义链的多个不同长度(462-1754 nt)的S. cerevisiae着丝粒转录物变异(Ling & Yuen 2019),与同种异构体RNA测序(Hedouin et al. 2022)一致。
图2
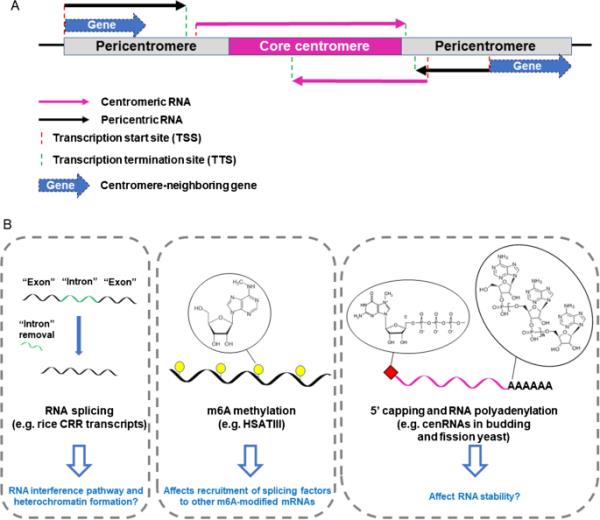
cenRNA和pericenRNA变异的机制及其潜在功能。RNA转录可以在不同的位点开始和终止。中心粒rna异构体覆盖部分或全部核心着丝粒区域,而周粒rna异构体靠近着丝粒区域,但不覆盖着丝粒区域。中心周围rna可能覆盖附近的部分基因,正如在出芽酵母中观察到的那样(Hedouin et al. 2022)。B cenrna和周状rna可以通过剪接(Neumann et al. 2007)、m6A甲基化(Xiao et al. 2016)、5 ' -capping (Choi et al. 2011)和聚腺苷化(Arunkumar and Melters 2020;Choi et al. 2011;Ling & Yuen 2019;Neumann et al. 2007)。这些cenRNA加工过程和产物的生物学功能不太确定,但可能类似于mrna或sRNAs
不同的稳定性
在人类细胞中,来自不同α -卫星阵列的cenrna表现出不同的稳定性(Arunkumar和Melters 2020)。在“活性着丝粒”阵列(例如DXZ1或D17Z1)中产生的CenRNA α -卫星与CENP-A和CENP-C相关,并且与与CENP-B相关的“非活性周中心”阵列(例如D17Z1- b)的转录本相比更稳定(McNulty et al. 2017)。
加工成更短的中心rna
只有少数研究揭示了cenRNA加工的细节,可能是因为很难追踪所有的cenRNA变体,这些变体可能是短暂的或不稳定的。在小鼠细胞中,虽然核心着丝粒前体细胞转录本约为2-4 kb,但也鉴定出了120 nt的次要卫星转录本(Bouzinba-Segard et al. 2006;Ferri et al. 2009)。这些数据表明,在作为RNA前体转录后,cenRNA可能会通过选择性剪接和转录后修饰进行加工(Wilkinson et al. 2020)。在水稻中,来自着丝粒反转录转座子(CRR)阵列的> 3 kb转录本被加工成长度约为24 nt的小RNA (sRNA),这在RNAi途径中起着维持异染色质的关键作用(Neumann et al. 2007)。此外,在裂变酵母中还观察到了内含子样元件剪接。剪接因子PRP16的突变会导致中心周围异染色质缺陷(Vijayakumari et al. 2019)。
m6A甲基化和剪接
最近,研究人员探索了周粒rna水平对mRNA剪接的影响(Ninomiya et al. 2021;Vourc 'h et al. 2022)。许多靶mrna含有N(6)-甲基腺苷(m6A)。m6A修饰需要一个m6A读取器YTHDC1来促进剪接(Xiao et al. 2016)。在热胁迫下,由中心点周围区域产生的HSATIII rna在HeLa细胞中高表达。这可能会隔离核应激体中的m6A写入复合物和YTHDC1 (nSB)(图2B)。这一过程将减少m6A甲基化和YTHDC1与靶mrna的结合,从而抑制靶mrna的剪接(Ninomiya et al. 2021)。
聚腺苷酸化
端粒重复序列RNA (TERRA)是由端粒DNA产生的lncRNA。大约7%的人类TERRA是聚腺苷化的,而大多数酵母TERRA是聚腺苷化的(Feuerhahn et al. 2010)。在不同的生物体中也发现了CenRNA聚腺苷化,包括出芽和裂变酵母、水稻、小鼠和人类(Arunkumar和Melters 2020;Choi et al. 2011;Ling & Yuen 2019;Neumann et al. 2007)。在出芽酵母中,用3 ' RACE用寡核苷酸(dT)引物检测到尾部聚腺苷化的着丝粒转录物(Ling & Yuen 2019)。同样,通过3 ' RACE在水稻中鉴定出具有不同终止位点的各种多(A)尾(图2B) (Neumann et al. 2007)。然而,可能不是所有的cenRNA和perienrna都被聚腺苷化。同样,在裂变酵母中也报道了中心rna或周中心rna的5 '盖帽(Arunkumar and Melters 2020;Choi et al. 2011)。然而,不同物种间5 ' capping或3 '聚腺苷化的中心RNA和周中心RNA的百分比也可能不同,RNA Pol ii来源的着丝粒转录物的聚腺苷化是否仅有助于其稳定性或具有其他功能还需要进一步探索。
总之,许多cenRNA和pericenRNA变异是由于转录期间和转录后的多个过程而产生的,包括不同的转录起始和终止位点,选择性剪接和修饰。细胞是否需要拥有不同丰度的cenRNA变体库仍不清楚。一些基因rna的高表达仅仅是因为附近基因表达的泄漏。研究不同的转录变体将有助于确定cenRNA的功能是否可以互换(可能在反式中),或者单个cenRNA变体是否具有独特的功能(可能在顺式中)。
下载原文档:https://link.springer.com/content/pdf/10.1007/s00412-023-00801-x.pdf
为您推荐:
- 新衣服穿之前一定要洗吗? 2025-07-08
- 在美国特使访问加沙地区之际,以色列对加沙地区发动袭击 2025-07-08
- 美国股市收盘走高,投资者消化了企业财报和大型股前景 2025-07-08
- 法庭对七名男子罚款,每人2000令吉,因为他们在超级联赛前在MBPJ体育场外打架时损坏了汽车 2025-07-08
- 投资者团体将梅西百货的收购报价提高到66亿美元 2025-07-08
- 美元小幅走低,欧元在关键通胀数据公布前上涨 2025-07-08


